A finales de noviembre se celebró en el Centro de Innovación de BBVA (Madrid) la conferencia ‘Reiniciando la forma de hacer Branding en el sector Salud en una Nueva Economía Conectada y Social’, organizada por Ideagoras, agencia líder en Social Media en el sector salud. A la jornada asistieron cerca de 500 personas (entre presenciales y virtuales) relacionadas de uno u otro modo con este sector: profesionales sanitarios (médicos, enfermeros y farmacéuticos), periodistas y comunicadores del sector salud, proveedores de soluciones tecnológicas, etc.
En su introducción, Ángel González, fundador de Ideagoras, manifestó que “la web social permite que el mundo sea mucho más plano” y añadió que “en un contexto económico como el actual lo que se impone es reiniciar, reinventar, renovarse, renacer y recuperar valores como la transparencia, honestidad y horizontalidad, que son los que imperan en la web social”.
Precisamente Marc Vidal, el primero de los ponentes de la jornada, se refirió a la horizontalidad durante su ponencia al señalar que “está demostrado que las empresas horizontales son más eficientes”. Para Vidal la evolución de Internet está influyendo en la forma de emprender. La conectividad de las personas permite hacer cosas que antes eran impensables. Vidal cree que ahora es un buen momento para emprender, pues gracias a la facilidad para cocrear y colaborar la red ofrece más oportunidades que nunca. Su fuerte vocación emprendedora le lleva a compararse con una cometa: “las cometas vuelan mucho más alto cuanto más fuerte sea el viento que tienen en contra”.
Antonio Ibarra, Director de Marketing Multicanal en Sanofi Pasteur MSD, se refirió a algunas iniciativas interesantes en el sector farmacéutico, como el uso de Yammer, una plataforma similar a Twitter que algunas organizaciones emplean en su comunicación interna (85% de las compañías del Fortune 500 lo utilizan). O la plataforma de innovación abierta de Lilly, que conecta a investigadores externos con los equipos de I+D de la farmacéutica, facilitando y haciendo mucho más eficiente el trabajo en equipo. Empresas como Pfizer están aprovechando la plataforma Spigit con el fin de obtener sugerencias de empleados para reducir costes, crear nuevos productos y potenciar la innovación en la organización.
Al ser cuestionados por Ibarra, la mayoría de los asistentes opinó que la industria farmacéutica no aprovecha las oportunidades que ofrecen las redes sociales. Según su parecer el sector farma va por detrás de otros en cuanto a dialogar con clientes. “La relación entre el público y la industria farmacéutica prácticamente no existe, por ningún medio”. Para Ibarra basta con consultar los datos de contacto en las páginas web de laboratorios como Pfizer, GlaxoSmithKline o Johnson & Johnson, donde no se informa de la presencia en Facebook o Twitter. En el caso de J&J sólo se informa a medios de comunicación, pero no al público general.
Francisco Lupiañez es profesor asociado en la Universitat Oberta de Catalunya y es un riguroso investigador del Internet Interdisciplinary Institute y del Grupo de Investigación Interdisciplinaria sobre las TIC. Su ponencia trató sobre cómo se puede segmentar a los ciudadanos en relación al uso de las TICs y de los medios sociales en relación con la salud. Según los datos expuestos, en la pirámide de los medios sociales los 'super users' sólo representan un 5,8% de la población, mientras que todavía hay un 37,5% de 'non users'.
El uso de los medios sociales en los países de habla alemana, como Alemania, Austria y Suiza fue el tema desarrollado por Michaela Endemann, consultora austriaca sobre medios sociales en salud. A pesar del elevado nivel de penetración de Internet en estos países, Endemann reconoce que un gran potencial de uso de los medios sociales en salud.
Con su natural gracejo andaluz Anabel Salazar, ginecóloga en el centro IVI de Sevilla, relató con notable sencillez y frescura de qué forma fue introducida en la web social y cuál ha sido su experiencia hasta la fecha como médico 2.0. “Steve Jobs me ha cambiado la vida”, empezó diciendo. Para Salazar, quien confesó no ser “ni CEO ni co-founder”, invertir algo de tiempo en la red resulta sin duda muy gratificante profesionalmente e ilustró su exposición con algunas de sus vivencias. Su apasionado discurso es capaz de convertir al más escéptico. Llegó a afirmar que los medios sociales deberían enseñarse en la facultad.
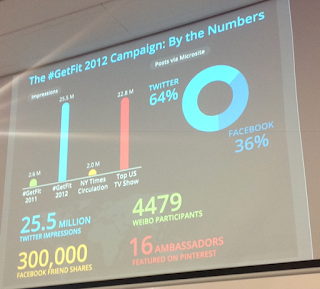
Verónica Botet, global digital PR manager de GE Healthcare, reflexionó sobre cómo debemos perder el miedo al uso de los medios sociales en la empresa e invitó a lanzarse a utilizarlos porque cree que pueden aportar mucho valor. Como ejemplo de ello presentó la concepción, desarrollo y resultados de la campaña #GetFit, una exitosa iniciativa en redes sociales (Twitter, Facebook y Sina Weibo) que pretendía concienciar sobre hábitos saludables como forma de prevenir el cáncer, apelando así a la participación activa y a la responsabilidad del individuo en el cuidado de su salud.
A Elena Sainz no le gusta que le pongan la etiqueta de ‘diabética’, prefiere que se la vea como una persona que tiene esa condición como una más de sus características. “La idea es quitarnos las etiquetas, las batas, los estetoscopios y compartir herramientas, ser iguales", manifestó durante su exposición, en la que relató cómo fue diagnosticada de diabetes y se formó hasta convertirse en educadora en esta dolencia, hasta llegar a poner en marcha el proyecto ‘Educadies: creatividad al servicio de la educación en salud’. Sainz recomendó la ‘Guía para el paciente participativo’, que puede descargarse gratuitamente y que, aunque va orientada a los pacientes de México, ofrece algunos criterios y consejos de utilidad general.
Thomas Lee, socio de Symplur, expuso su visión sobre la evolución de Twitter en salud, su uso entre los profesionales sanitarios y los pacientes y sobre el proyecto Symplur, una base de datos sobre las etiquetas (hashtags) más utilizadas en el entorno sanitario. Symplur se revela como un gran servicio para la comunidad sanitaria, al tiempo que ofrece todo su potencial a las empresas interesadas para extraer conocimiento de la ingente cantidad de datos que acumula.
Para finalizar, Paul Connolly presentó C8 MediSensors, un Nuevo medidor de glucosa no invasivo para diabéticos, formado por un sensor que se coloca adherido al abdomen y que cada seis minutos lee la glucosa en sangre utilizando un sistema óptico (espectroscopia Raman). Los datos se envían vía Bluetooth a un teléfono inteligente. El dispositivo aún no está comercializado y espera obtener la aprobación para su introducción en Europa y posteriormente en EE.UU. Sin duda un práctico ejemplo del uso de las nuevas tecnologías aplicadas al campo de la salud.
Tuesday, December 4, 2012
Sunday, September 30, 2012
Entrevista a John Mack
John Mack, conocido popularmente como Pharmaguy (@pharmaguy), es el editor de Pharma Marketing News, un boletín electrónico mensual independiente que cubre temas de especial relevancia para los ejecutivos de marketing de la industria farmacéutica. John, quien además es un prolífico bloguero, presentó en Barcelona su ponencia ‘Pruebas y Tribulaciones de la Industria Farmacéutica en los Medios Sociales’, en la que repasa los hitos más importantes que han tenido lugar durante los últimos seis años así como los principales problemas o fracasos.
A continuación transcribo el contenido íntegro de la entrevista que le hice con motivo de la mencionada presentación. La versión en castellano se puede leer en elglobal.net.
Q. In your presentation your first milestone dates back to April 2006. Much has happened since. What's your assessment of these past years in Social Media and Pharma?
A. I started my Pharma Social Media Timeline in 2005/6 because that is when the modern era of social media began with Blogger, for example. I started blogging in January 2005. This was the beginning of what used to be called the Web 2.0 era, where social media tools like Blogger were offered to ordinary users to create content and communities.
The pharmaceutical industry was, in some respects, an “early adopter” of modern social media. But you really have to look at individual pharma companies to assess how sectors of the industry are using social media. GlaxoSmithKline, for example, has truly been an early adopter of the “spirit” of modern social media– I recall that it sponsored an online smoking cessation forum on an a third-party patient site before 2000. But that was a Web 1.0 experience although there was true community amongst forum members at the time.
Aside from viewing the pharma industry as a monolithic use of social media, the other problem is defining exactly what aspect of social media should we be looking at. I think the most important aspect is the direct conversation between pharma and its audience via social media such as Twitter, Facebook, and blogs. Some pharma companies are better than others at engaging in this conversation, but the industry as a whole have made great progress. Many companies now routinely handle customer complaints via Twitter and some have Facebook pages or their own sites that allow comments and conversation from and to consumers.
Q. What should be the role of pharma companies in relation to Social Media?
A. There are many ways that pharma companies can use social media. From the point of view of patients, pharma can use social media to support their products – ie, help patients report AEs [adverse events]. Of course, there is a problem in drawing the line between support and product promotion, which is not allowed in the EU.
Q. What are the main mistakes that have been made by pharma companies?
A. That’s difficult to say – there have been many kinds of mistakes. Hopefully, the industry has learned from these mistakes. Probably the biggest mistake a company can make when initiating a social media campaign is not to be prepared for crises that may arise. Companies must have robust social media standard operating procedures to cover all contingencies.
Q. What have they done correctly? Which companies in your opinion are doing things right?
A. Many companies are doing some things right and most are doing some things wrong. So I cannot single out one company that has done everything right, IMHO, with regard to social media. Boehringer Ingelheim has been noteworthy in my view of doing some things really right (eg, engaging consumers/patients via Twitter) and some things really wrong (humorous YouTube video). Pfizer is another example. The most recent social media campaign that Pfizer is doing “right” is the Getting Old campaign.
Q. FDA promised guidelines “by the end of 2010" and so far they have only issued a draft that focuses exclusively on social media discussion of off-label medication use. What are your expectations for the near future?
A. A little-noticed "Miscellaneous Provision" of the "Food and Drug Administration Safety and Innovation Act" (aka PDUFA), which was signed into law by president Obama on July 10, 2012, simply states that “not later than 2 years after the date of enactment of this Act, the Secretary of Health and Human Services shall issue guidance that describes Food and Drug Administration policy regarding the promotion, using the Internet (including social media), of medical products that are regulated by such Administration.”
This, however, may have more bark than bite. It seems that the FDA will dole out social media guidelines as part of other guidelines – as they did with guideline for responding to off-label questions. Yet the FDA has not come up with any guidelines covering topics discussed at the November 2009 public hearing. It’s difficult to be optimistic about this given all the other things on FDA’s plate. Plus, there are a few legal, first amendment challenges that pharma has raised AGAINST FDA’s guideline process. Some pharma companies – notably Pfizer – demand FDA develop new legally-binding REGULATIONS regarding social media. The problem is that guidelines are not legally binding, so a new FDA administration can ignore guidelines written in the past.
Q. Pre-moderation or post-moderation for pharma social media sites? What do you prefer or recommend?
A. I prefer pre-moderation although it may inhibit social media “conversation.” In my view, pharma will never have real conversations via social media, so why worry about inhibiting it? Pfizer pre-moderates in Getting Old site and seems to be doing well – although it enhances the “conversation” by working with patient organization partners who submit most of the content.
Q. What advice would you give to a pharma company that is determined to invest their efforts on Social Media and wants to do the right thing?
A. Invite me in to discuss Pharma’s Social Media Trials & Tribulations to learn about the issues and how to avoid making mistakes.
A continuación transcribo el contenido íntegro de la entrevista que le hice con motivo de la mencionada presentación. La versión en castellano se puede leer en elglobal.net.
Q. In your presentation your first milestone dates back to April 2006. Much has happened since. What's your assessment of these past years in Social Media and Pharma?
A. I started my Pharma Social Media Timeline in 2005/6 because that is when the modern era of social media began with Blogger, for example. I started blogging in January 2005. This was the beginning of what used to be called the Web 2.0 era, where social media tools like Blogger were offered to ordinary users to create content and communities.
The pharmaceutical industry was, in some respects, an “early adopter” of modern social media. But you really have to look at individual pharma companies to assess how sectors of the industry are using social media. GlaxoSmithKline, for example, has truly been an early adopter of the “spirit” of modern social media– I recall that it sponsored an online smoking cessation forum on an a third-party patient site before 2000. But that was a Web 1.0 experience although there was true community amongst forum members at the time.
Aside from viewing the pharma industry as a monolithic use of social media, the other problem is defining exactly what aspect of social media should we be looking at. I think the most important aspect is the direct conversation between pharma and its audience via social media such as Twitter, Facebook, and blogs. Some pharma companies are better than others at engaging in this conversation, but the industry as a whole have made great progress. Many companies now routinely handle customer complaints via Twitter and some have Facebook pages or their own sites that allow comments and conversation from and to consumers.
Q. What should be the role of pharma companies in relation to Social Media?
A. There are many ways that pharma companies can use social media. From the point of view of patients, pharma can use social media to support their products – ie, help patients report AEs [adverse events]. Of course, there is a problem in drawing the line between support and product promotion, which is not allowed in the EU.
Q. What are the main mistakes that have been made by pharma companies?
A. That’s difficult to say – there have been many kinds of mistakes. Hopefully, the industry has learned from these mistakes. Probably the biggest mistake a company can make when initiating a social media campaign is not to be prepared for crises that may arise. Companies must have robust social media standard operating procedures to cover all contingencies.
Q. What have they done correctly? Which companies in your opinion are doing things right?
A. Many companies are doing some things right and most are doing some things wrong. So I cannot single out one company that has done everything right, IMHO, with regard to social media. Boehringer Ingelheim has been noteworthy in my view of doing some things really right (eg, engaging consumers/patients via Twitter) and some things really wrong (humorous YouTube video). Pfizer is another example. The most recent social media campaign that Pfizer is doing “right” is the Getting Old campaign.
Q. FDA promised guidelines “by the end of 2010" and so far they have only issued a draft that focuses exclusively on social media discussion of off-label medication use. What are your expectations for the near future?
A. A little-noticed "Miscellaneous Provision" of the "Food and Drug Administration Safety and Innovation Act" (aka PDUFA), which was signed into law by president Obama on July 10, 2012, simply states that “not later than 2 years after the date of enactment of this Act, the Secretary of Health and Human Services shall issue guidance that describes Food and Drug Administration policy regarding the promotion, using the Internet (including social media), of medical products that are regulated by such Administration.”
This, however, may have more bark than bite. It seems that the FDA will dole out social media guidelines as part of other guidelines – as they did with guideline for responding to off-label questions. Yet the FDA has not come up with any guidelines covering topics discussed at the November 2009 public hearing. It’s difficult to be optimistic about this given all the other things on FDA’s plate. Plus, there are a few legal, first amendment challenges that pharma has raised AGAINST FDA’s guideline process. Some pharma companies – notably Pfizer – demand FDA develop new legally-binding REGULATIONS regarding social media. The problem is that guidelines are not legally binding, so a new FDA administration can ignore guidelines written in the past.
Q. Pre-moderation or post-moderation for pharma social media sites? What do you prefer or recommend?
A. I prefer pre-moderation although it may inhibit social media “conversation.” In my view, pharma will never have real conversations via social media, so why worry about inhibiting it? Pfizer pre-moderates in Getting Old site and seems to be doing well – although it enhances the “conversation” by working with patient organization partners who submit most of the content.
Q. What advice would you give to a pharma company that is determined to invest their efforts on Social Media and wants to do the right thing?
A. Invite me in to discuss Pharma’s Social Media Trials & Tribulations to learn about the issues and how to avoid making mistakes.
Monday, August 6, 2012
Crecen los acuerdos con centros académicos
Novartis y la Universidad de Pensilvania acaban de firmar un acuerdo para investigar una nueva vía de tratamiento del cáncer (nota de prensa de Novartis). Un grupo de científicos de la universidad norteamericana obtuvo el pasado año resultados muy prometedores en el tratamiento de la leucemia linfocítica crónica. Dos de los pacientes tratados incluso lograron la completa remisión de la enfermedad. El nuevo tratamiento emplea una forma inocua del virus HIV-1 (vector) para transportar genes a los linfocitos T de los pacientes, confiriendo a éstos una mayor capacidad para luchar contra el cáncer. La técnica puede ser aplicada no sólo para tratar la leucemia, sino también otros tumores.
Mediante el acuerdo Novartis obtiene los derechos exclusivos de comercialización a nivel mundial a cambio de pagar unos royalties a la Universidad de Pensilvania por aportar su experiencia y capacidad investigadora.
Según un informe de Burrill & Company desde 2009 se constata un retroceso en acuerdos de compañías farmacéuticas con empresas de biotecnología debido en parte al crecimiento de las colaboraciones con organizaciones académicas.
Friday, July 27, 2012
Truvada: primer tratamiento preventivo contra el VIH
La pasada semana la FDA concedió a Gilead la autorización para comercializar Truvada en la prevención de la infección por VIH [nota de prensa de la FDA]. Se trata del primer medicamento que obtiene esta indicación. Gilead comercializa este producto desde 2004 para el tratamiento de la infección [productos comercializados por Gilead contra el HIV]. La aprobación para la prevención se basa en dos estudios clínicos, en los que el fármaco demostró reducir de un modo notable el riesgo de adquirir el virus. Truvada es una tableta que contiene una combinación de dos antivíricos: Emtriva (emtricitabina) y Viread (tenofovir). Ambos se usan en el tratamiento de la hepatitis B crónica.
Según los estudios llevados a cabo, las personas que más se beneficiaron de la medicación fueron aquellas que no usaban el preservativo con regularidad. En cambio, aquellas que sí lo hacían y que además no practicaban sexo anal, no obtenían un beneficio adicional por seguir el tratamiento. Sin duda la mejor prevención es el uso del preservativo. Para quienes carecen de la disciplina necesaria para protegerse con éste, la alternativa es Truvada, un tratamiento que tiene un coste anual de 14.000 dólares. Se estima que en EE.UU. hay unas 415.000 personas en riesgo de infectarse por el VIH.
Algunas voces se oponen al uso de Truvada en prevención, ya que temen que puede dar una falsa sensación de seguridad a quienes lo toman con esta finalidad. Este argumento es rechazado por los científicos de la FDA, quienes argumentan que en los estudios no se observó evidencia alguna de que los usuarios puedan adoptar prácticas sexuales de mayor riesgo por el hecho de tomar el fármaco.
La aprobación de Truvada llegó una semana después de que las autoridades norteamericanas diesen la luz verde a la comercialización del primer test OTC para la detección del VIH. Estos dos avances marcan sendos hitos en los más de treinta años que la comunidad científica lleva luchando contra este virus.
Tuesday, July 3, 2012
Multa récord para GlaxoSmithKline en EE.UU.
GlaxoSmithKline acaba de batir en EE.UU. el récord de multas impuestas a farmacéuticas, pues deberá pagar 3.000 millones de dólares al declararse culpable por sus malas prácticas del pasado, consistentes en promocionar de manera ilegal los antidepresivos Paxil (paroxetina DCI) y Wellbutrin (bupropion DCI) y por ocultar datos de seguridad del antidiabético Avandia (rosiglitazona DCI).
Los instructores federales del caso manifestaron que la compañía británica pagó a médicos por asistir a reuniones en las que se promocionaron indicaciones no aprobadas por la FDA, como el uso de Paxil en niños y adolescentes o, en el caso de Wellbutrin, el tratamiento de la obesidad, la disfunción sexual o el trastorno por déficit de atención con hiperactividad (TDAH), mientras su única indicación legal era la depresión mayor.
Según los intructores, entre los años 2011 y 2007 GlaxoSmithKline ocultó a la FDA datos de seguridad obtenidos a partir de ciertos estudios realizados con Avandia. Recordemos que en 2007 el Dr. Steven Nissen, catedrático del Departamento de Medicina Cardiovascular del Hospital Clínico de Cleveland (Ohio), causó un importante revuelo al publicar los resultados de un metaanálisis de 42 estudios clínicos que le condujeron a concluir que el tratamiento con Avandia incrementa en un 43 por ciento el riesgo de infarto y un 64 por ciento el riesgo de muerte por causa cardiovascular.
En septiembre de 2010 los datos Dr. Nissen se vieron respaldados por la decisión de la Agencia Europea del Medicamento de supender la autorización de comercialización en la Unión Europea de Avandia / Avandamet / Avaglim (rosiglitazona DCI). Por su parte, la FDA decidió asimismo restringir su uso tras revisar los datos de seguridad del fármaco y concluir sus beneficios terapéuticos se veían superados por un mayor riesgo cardiovascular.
Curiosamente en un día en que el Dow Jones ha perdido un 0,07%, las acciones de GSK se han revalorizado un 1,73%. Tal y como señala Matthew Herper, ello puede explicarse en parte por el hecho de que los términos iniciales del acuerdo tuvieron lugar en noviembre pasado y GSK hizo la provisión de fondos correspondiente. Además GSK y su socio Theravance han anunciado hoy buenos resultados clínicos con un nuevo antiasmático inhalado.
La nota de prensa de GSK contiene la siguiente declaración de Andrew Witty, consejero delegado de GSK:
"Mientras que éstas [acciones ilegales] se originaron en una época distinta para la compañía, no pueden y no serán ignoradas. En nombre de GSK, quiero expresar nuestro pesar y reiteramos que hemos aprendido de los errores que cometimos".
Más allá de sus palabras, creo que es justo reconocer los esfuerzos de Witty por mejorar la reputación de GSK. En 2011 implementó en EE.UU. un nuevo sistema de incentivos para los visitadores médicos, eliminando los objetivos individuales como base de su compensación y en su lugar ahora se valora la calidad del servicio de estos profesionales a sus clientes para apoyarles en la mejora de la salud de los pacientes. Asimismo Witty trata de mejorar el acceso a los medicamentos y a las vacunas en países con escasos recursos e impulsa su desarrollo, como la vacuna para la malaria, que realiza en colaboración con la Fundación Bill y Melinda Gates (al respecto es interesante ver esta entrevista).
Multas impuestas con anterioridad a farmacéuticas:
Junio 2012: J&J pagará 2.200 millones de dólares por promover ilegalmente Risperdal y otros medicamentos.
Mayo 2012: Abbott pagará 1.500 millones de dólares por promoción de indicaciones no aprobadas de Depakote.
Septiembre 2009: Pfizer acuerda pagar 2.300 millones de dólares por prácticas ilegales en la comercialización de Bextra.
Monday, July 2, 2012
Bristol-Myers Squibb compra Amylin
Bristol-Myers Squibb (BMS) ha conseguido finalmente hacerse con el control de la californiana Amylin (nota de prensa), fabricante de los antidiabéticos Byetta y Bydureon, tras acordar el pasado viernes un pago de 5.300 millones de dólares (31 dólares por acción). Como parte del acuerdo debe añadir además 1.700 millones de dólares en concepto de deuda y de abono de derechos a Eli Lilly, el socio actual de Amylin, con lo que en la práctica el acuerdo de adquisición asciende a 7.000 millones de dólares. BMS a su vez ha acordado con AstraZéneca fortalecer su alianza en el campo de la diabetes, compartiendo los costes y los beneficios del acuerdo a cambio de obtener 3.400 millones de dólares. AstraZéneca tiene la opción de pagar 135 millones de dólares extra (la mitad de los costes de la transacción) a cambio de tener los mismos derechos políticos que BMS en cuanto a las decisiones estratégicas y financieras de la joint venture.
El pasado mes de febrero BMS hizo una primera oferta de 3.500 millones de dólares, que Amylin rechazó por considerarla demasiado baja, debido a que, en su opinión, se había basado sólo en información pública disponible. Desde entonces varias compañías, entre las que se encuentran Merck & Co, Novartis y Sanofi, se habían interesado por la californiana. Finalmente han sido BMS y AstraZéneca (que acordaron no competir entre ellas) las que han culminado la adquisición. Según Bloomberg, la industria farmacéutica perdió el pasado año la protección de patente para productos que aportaron 37.000 millones de dólares de ingresos. Por otra parte en 2015 los ingresos bajo amenaza de sufrir la competencia de genéricos ascenderán a 147.000 millones de dólares. Desde hace un tiempo Bristol trata de encontrar reemplazo a la facturación que perderá por el vencimiento de la patente de Plavix. Recordemos que BMS mantiene con Sanofi un acuerdo de comercialización de Plavix y que en mayo venció su patente en EE.UU. Por su parte, la patente de Seroquel en EE.UU. venció en marzo.
El hecho de compartir la adquisición permite a AstraZéneca mantener el pago de dividendos a sus accionistas, así como la recompra de acciones y refuerza las posibilidades de que Simon Lowth, consejero delegado interino tras la precipitada marcha de David Brennan (según algunos por no ser capaz de conseguir refrescar el pipeline), sea finalmente el elegido para comandar la compañía anglo-sueca. Según Financial Times, los inversores de AstraZéneca se encuentran divididos, entre aquellos que desean una actitud más audaz, con nuevas adquisiciones y acuerdos de licencia, y aquellos que prefieren obtener rentabilidad de sus acciones.
Respecto al monto de la operación, mientras algunos analistas creen que el precio acordado se encuentra en el límite superior, otros los consideran desorbitado y sólo se lo explican por la situación desesperada a la que se enfrentan algunas farmacéuticas para conseguir mantener sus ingresos.
Amylin ha estado buscando un socio desde que finalizó el pasado noviembre su acuerdo con Eli Lilly, quien decidió participar con Boehringer Ingelheim en el desarrollo de linagliptina DCI, un producto posible competidor de Byetta y Bydureon, por ser todos ellos análogos del péptido similar al glucagón de tipo 1 (GLP-1), empleados en el tratamiento de la diabetes tipo 2. En 2011 los ingresos de Amylin ascendieron a 650 millones de dólares y se espera un aumento del 5 por ciento para este año, según estimaciones de analistas obtenidas por Bloomberg. Según un analista de Cowen & Co (Nueva York), los ingresos de Amylin podrían alcanzar los 1.500 millones de dólares.
Byetta (exenatida DCI) se inyecta dos veces al día y sus prescripciones han descendido desde 2008, en parte por dudas sobre su seguridad y en parte por competencia de Victoza (liraglutida DCI), otro antidiabético agonista de los receptores GLP-1, comercializado por Novo Nordisk, que sólo requiere de una inyección diaria y que ha alcanzado ya el nivel de blockbuster. Las ventas de Byetta en 2011 fueron 518 millones de dólares, mientras que en 2009 sumaron 668 millones. Tras dos rechazos previos, Amylin obtuvo de la FDA en enero la aprobación de Bydureon, que se inyecta una sola vez por semana. Amylin vende además Symlin (pramlintida acetato DCI), aprobado para tratar la diabetes tipo 1 y 2, y que en 2011 consiguió 104 millones de dólares.
BMS y AstraZeneca comercializan juntos Onglyza (saxagliptina DCI), un inhibidor de la DPP-4 (dipeptidil peptidasa). Onglyza ha sido aprobado en 77 países, y, entre otros, se encuentra en EE.UU., Canada, Mexico, la Unión Europea, India, Brasil y China. Onglyza no ha tenido buenos resultados en su competición con Januvia (sitagliptina DCI), el primer producto de esta familia, introducido por Merck & Co en 2006 y que alcanza ventas anuales de 4.700 millones de dólares, diez veces más que Onglyza. BMS y AstraZéneca trabajan además en dapagliflocina DCI, un inhibidor de SGLT-2 (transportador de glucosa dependiente de sodio). El pasado abril obtuvo opinión positiva del Comité de Medicamentos para Uso Humano (CHMP) de la EMA. La cartera de Amylin viene por tanto a complementar la oferta de BMS y AstraZéneca en diabetes.
Sunday, May 13, 2012
El plan de reestructuración de Pfizer
Desde enero de 2009 Pfizer ha sido especialmente activa en cuanto a iniciativas que compensasen el descenso previsto de facturación como consecuencia de la pérdida de exclusividad de comercialización de algunos de sus productos más importantes. Ese mes anunció un plan para reducir los gastos en 3.000 millones de dólares. La compra de Wyeth (tercera megafusión de Pfizer), completada en octubre de aquel año, llevó a incrementar esa cifra hasta los 4.000 millones de dólares.
En febrero de 2011, durante la presentación de resultados la compañía anunció un plan de reestructuración de su I+D que incluía un recorte de la inversión por valor de 1.500 millones de dólares. El anunció del cierre del centro ubicado en Sandwich (Reino Unido) y el consiguiente despido de 2.400 investigadores y personal de soporte causó un notable revuelo.
Ian Read, quien hacía poco había reemplazado a Jeffrey Kindler en el puesto de consejero delegado, hizo público el abandono de los proyectos de las áreas de urología y medicina interna, mientras se mantenían cardiovascular y trastornos metabólicos, inflamación e inmunología, neurociencias y dolor, oncología y vacunas.
La compañía respondía así a una serie de reveses recientes: bosutinib no salió bien parado en un estudio comparativo con Gleevec; hubo dos estudios fallidos con Sutent (sunitinib); debió abandonar Thelin (sitaxentan) por problemas de toxicidad hepática; y tuvo que poner fin a un estudio de fase 3 (ADOPT) con apixaban. Asimismo, dos de sus principales productos, Lipitor y Viagra, se aproximaban al vencimiento de sus patentes. Se llegó a estimar que Pfizer perdería un tercio de sus ingresos como consecuencia de los vencimientos de patentes y la consiguiente entrada de genéricos.
El plan de reestructuración de Pfizer fue revisado en el mes de julio de 2011 con el fin de evaluar alternativas estratégicas para las divisiones de sanidad animal y nutrición infantil. La nortemericana se proponía así focalizarse en su core business biofarmacéutico.
La venta de la división de nutrición infantil se ha consumado recientemente en un acuerdo con la suiza Nestlé y en la última presentación de resultados Frank A. D'Amelio (Chief Financial Officer) ratificó el objetivo de deshacerse de la división de sanidad animal entre julio de 2012 y julio de 2013.
En lo sustancial el plan de reestructuración no se diferencia de los planes puestos en marcha por otras grandes farmacéuticas afectadas por importantes vencimientos de patentes: reducción de gastos, focalización en el core business, adquisiciones y acuerdos de menor dimensión con encaje estratégico y expansión en países emergentes.
En cuanto a la cartera de productos, ¿cuáles van a seguir siendo prioritarios y cuáles no? La decisión de abandonar la promoción de Lipitor nos lleva a pensar que Pfizer lo incluirá en su cartera de Productos Establecidos, aquellos que, como Lipitor o Zoloft (sertralina), han perdido la protección de la patente o la exclusividad de comercialización en algunos mercados clave. Según Tim Anderson, analista de Bernstein Research, otros cinco productos (además de Lipitor) se podrían sumar a este grupo: Aromasin (exemestano), Caduet (amlodipino/atorvastatina), Celebrex (celecoxib), Detrol (tolterodina) y Geodon/Zeldox (ziprasidona). Este analista llegó a sugerir en una nota la posibilidad de que Pfizer vendiera (spin off) esta división.
En lo que atañe a los productos que se mantendrán por ahora como prioritarios figuran probablemente: Lyrica, Prevnar-7v/-13v, Enbrel, Viagra, Zyvox, Sutent, BeneFIX, Chantix/Champix, Pristiq y productos en co-promoción como Aricept (donepezilo), Eliquis (apixaban; anticoagulante; en registro), crizotinib (cáncer; en registro), tofacitinib (psoriasis; en fase 3), y Prevnar-13v para adultos (prevención de neumonía).
El pipeline [pdf] contenía a finales de febrero un total de 90 productos (cinco menos que en la anterior revisión): 26 en fase 1, 35 en fase 2, 18 en fase 3 y 11 en registro.
Friday, May 11, 2012
Pfizer abandona la promoción de Lipitor
El pasado 30 de noviembre venció en EE.UU. la patente de Lipitor (atorvastatina), el producto más importante de Pfizer en términos de facturación. Desde entonces en aquel país la compañía ha intentado de forma muy agresiva (con cupones, descuentos y contratos especiales con las PBM) frenar la caída de sus ingresos. Cinco meses más tarde, tras haber invertido más de 87 millones de dólares en promoción (según Cegedim Strategic Data), Pfizer ha decidido arrojar la toalla.
A partir del próximo 31 de mayo la norteamericana deberá hacer frente a la competencia de nuevas versiones genéricas a un precio todavía menor. En EE.UU. la ley Hatch-Waxman concede 180 días de exclusividad a los primeros genéricos en solicitar el registro. En el caso de Lipitor, los genéricos autorizados han sido dos, los fabricados por Watson y por Ranbaxy.
La estrategia 'Lipitor for You' no ha alcanzado el objetivo de mantener (seis meses después de expirar la patente) en un 40 por ciento la participación de mercado de Lipitor en la venta total de atorvastatina. Según ha informado el Wall Street Journal, cinco meses después de la pérdida de exclusividad una de cada tres atorvastatinas es Lipitor (un 33 por ciento de participación).
Pfizer ha dejado de promover Lipitor entre los médicos, así como ha suprimido la inversión en televisión, prensa y online. La compañía llegó a manejar para la promoción de su producto contra el colesterol un presupuesto anual de 279,1 millones de dólares.
El proceso de reestructuración de Pfizer sigue su curso y recientemente acordó vender a Nestlé su división de nutrición infantil (tal como comentábamos hace unas semanas). Asimismo planea vender también su negocio de salud animal.
A partir del próximo 31 de mayo la norteamericana deberá hacer frente a la competencia de nuevas versiones genéricas a un precio todavía menor. En EE.UU. la ley Hatch-Waxman concede 180 días de exclusividad a los primeros genéricos en solicitar el registro. En el caso de Lipitor, los genéricos autorizados han sido dos, los fabricados por Watson y por Ranbaxy.
La estrategia 'Lipitor for You' no ha alcanzado el objetivo de mantener (seis meses después de expirar la patente) en un 40 por ciento la participación de mercado de Lipitor en la venta total de atorvastatina. Según ha informado el Wall Street Journal, cinco meses después de la pérdida de exclusividad una de cada tres atorvastatinas es Lipitor (un 33 por ciento de participación).
Pfizer ha dejado de promover Lipitor entre los médicos, así como ha suprimido la inversión en televisión, prensa y online. La compañía llegó a manejar para la promoción de su producto contra el colesterol un presupuesto anual de 279,1 millones de dólares.
El proceso de reestructuración de Pfizer sigue su curso y recientemente acordó vender a Nestlé su división de nutrición infantil (tal como comentábamos hace unas semanas). Asimismo planea vender también su negocio de salud animal.
Thursday, April 26, 2012
Watson acuerda comprar Actavis
Reuters informó hace aproximadamente un mes de la posibilidad y finalmente se ha materializado: la norteamericana Watson Pharmaceuticals ha acordado adquirir Actavis Group por 5.600 millones de dólares (unos 4.250 millones de euros), lo que la convertirá en el tercer fabricante de genéricos a nivel mundial, detrás de la israelí Teva y la suiza Sandoz. Watson espera alcanzar con esta operación un ahorro de costes neto de unos 300 millones de dólares anuales.
El sector de genéricos goza de muy buena salud, pues se ve favorecido por las políticas farmacéuticas de los gobiernos occidentales, que promueven el uso de los medicamentos más baratos con el fin de reducir el gasto en farmacia. Por ello el sector vive desde hace algún tiempo un proceso de consolidación, en el que las compañías buscan obtener economías de escala y alcance que les permitan producir a unos costes unitarios lo más bajos posibles.
Esta operación beneficia especialmente a Deutsche Bank, pues el banco alemán tiene invertidos en Actavis unos 3.500 millones de euros de deuda senior. Tras una rápida expansión a principios de la pasada década, el magnate islandés Bjorgolfur Thor Bjorgolfsson llevó a cabo una adquisición apalancada (leveraged buyout) de Actavis mediante una emisión de deuda senior que colocó a Deutsche Bank.
Es de suponer que Watson tiene un buen conocimiento de Actavis, dado que Sigurdur Oli Olafsson, antiguo consejero delegado de ésta trabaja para la norteamericana, a donde llegó en septiembre de 2010 para hacerse cargo del negocio global de genéricos.
Cabe esperar que la operación contribuya a la expansión internacional de Watson, sobre todo en Rusia y en países del centro y este de Europa. Ya el pasado mes de mayo acordó pagar 562 millones de dólares para hacerse con la propiedad del fabricante de genéricos griego Specifar Pharmaceuticals.
El pasado mes de diciembre se hizo público el anuncio de un acuerdo entre Watson y Amgen, la mayor biotecnológica del mundo, para crear versiones biosimilares de varios productos contra el cáncer.
Watson ostenta en la actualidad el cuarto lugar del ranking mundial de facturación de genéricos y Actavis ocupa la decimoquinta posición, según datos de IMS Health. La integración de Actavis hará que Watson escale hasta la tercera posición. Watson se ha beneficiado recientemente de la venta desde el pasado mes de diciembre de la versión genérica de Lipitor (atorvastatina DCI).
Actavis, que opera en 40 países y emplea a unas 10.000 personas, fue fundada en Islandia en 1956 y hace un año traslado su sede a Zurich (Suiza).
Sunday, April 22, 2012
Sobre el despilfarro de medicamentos
Entre las medidas anunciadas esta semana por el Ministerio de Sanidad se incluye el ajuste del tamaño de los envases a la duración del tratamiento, con el fin de evitar el 'despilfarro' que supone tirar 3.700 toneladas de medicamentos a la basura cada año. Es preciso puntualizar que esta afirmación, que ha sido jaleada con poco sentido crítico por numerosos medios de comunicación, no responde a la realidad.
Los españoles no hemos despilfarrado 3.700 toneladas de medicamentos el pasado año. De hecho, se desconoce la cantidad de los medicamentos que se haya podido desperdiciar. La cifra mencionada corresponde a la cantidad de residuos de medicamentos que se recoge a través del Sistema Integrado de Gestión y Recogida de Envases (SIGRE), un sistema de recogida selectiva puesto en marcha por la industria farmacéutica hace poco más de una década, y que cuenta con la participación activa de las oficinas de farmacia y de las empresas de distribución farmacéutica.
En 2011 un total de 20.958 farmacias colaboraron con Sigre en la recogida de residuos de medicamentos y otros productos. Los ciudadanos no sólo depositan en los puntos Sigre los medicamentos caducados o restos de tratamientos que han finalizado, sino que también desechan restos de productos de parafarmacia (cosmética, nutrición, etc.), que no son medicamentos. Según Sigre, más del 18 por ciento de los productos que se recogen pertenece a esta categoría (ver el gráfico 1). Por lo tanto, de las 3.700 toneladas señaladas, unas 3.000 corresponderían a residuos medicamentosos (que equivaldría tan sólo a un promedio de un envase por habitante y año) .
 |
| Gráfico 1 |
A veces llegan al Sigre medicamentos sin consumir, de pacientes que han fallecido o a los que el médico les ha cambiado el tratamiento. ¿Se puede considerar ésto despilfarro? Téngase en cuenta que en el momento en que una especialidad farmacéutica ha salido del circuito sanitario y, en consecuencia, del control profesional del farmacéutico, no puede volver a ser dispensada, ya que no se puede garantizar ni la custodia y ni la conservación correctas, responsabilidades que la ley otorga al farmacéutico. Se trata así de proteger la salud de los ciudadanos.
La mayor parte de los residuos que llegan al Sigre está formada fundamentalmente por cartón, plástico, papel, los materiales de los que están hechos los envases primarios y secundarios de los medicamentos. Además parte de los residuos corresponden a medicamentos que los ciudadanos han costeado con dinero de su propio bolsillo. Por lo tanto, el valor de lo verdaderamente despilfarrado sea tal vez muchísimo menor de lo que se nos pretende hacer creer. Da la impresión de que se nos trata de inculcar a profesionales sanitarios y a ciudadanos un cierto sentimiento de culpa (por exceso de prescripción, de consumo o de despilfarro) que busca predisponernos a una mejor aceptación de las medidas de recorte farmacéutico y modificar nuestro comportamiento para reducir la cifra del gasto público en medicamentos.
La mayor parte de los residuos que llegan al Sigre está formada fundamentalmente por cartón, plástico, papel, los materiales de los que están hechos los envases primarios y secundarios de los medicamentos. Además parte de los residuos corresponden a medicamentos que los ciudadanos han costeado con dinero de su propio bolsillo. Por lo tanto, el valor de lo verdaderamente despilfarrado sea tal vez muchísimo menor de lo que se nos pretende hacer creer. Da la impresión de que se nos trata de inculcar a profesionales sanitarios y a ciudadanos un cierto sentimiento de culpa (por exceso de prescripción, de consumo o de despilfarro) que busca predisponernos a una mejor aceptación de las medidas de recorte farmacéutico y modificar nuestro comportamiento para reducir la cifra del gasto público en medicamentos.
+03.53.28.png) |
| Gráfico 2 |
Desfortunadamente no todos los medicamentos llegan al circuito de Sigre. Algunos puede que se hallen aún en cajones o en botiquines caseros y otros han podido ir directamente a la basura. Teniendo en cuenta el número de envases de medicamentos comercializados (cerca de los 1.500 millones de unidades, más de 30 por habitante y año), la mayoría de los envases de éstos no llega al Sigre. Por ejemplo, ¿cuántos ciudadanos llevan a la farmacia el envase de un jarabe, una vez consumido éste? No obstante, la cantidad recogida a través de Sigre ha ido en aumento cada año (ver gráfico 2), como resultado de la consolidación de este sistema, constatándose una mayor concienciación de los ciudadanos.
Por último, la adopción de medidas conducentes a mejorar la adherencia a determinados tratamientos no sólo mejoraría los resultados terapéuticos, sino que contribuiría a reducir los residuos de medicamentos.
Wednesday, April 18, 2012
Seis posibles revulsivos para las cotizaciones de las farmacéuticas
Según ha informado este martes el Wall Street Journal, Pfizer estaría a punto de cerrar un acuerdo con Nestlé para venderle su división de Nutrición, que comercializa principalmente productos de alimentación infantil.
Al parecer Nestlé habría superado con su oferta a la del equipo formado por Danone y Mead Johnson Nutrition. El importe de la operación se situaría en torno a los 9.000 millones de dólares.
Este es uno de los seis movimientos que según Tony Butler, veterano analista del sector farmacéutico en Barclays Capital, podrían actuar durante el segundo semestre de este año como revulsivos de las acciones de las farmacéuticas. Los otros cinco, según recoge en su blog Matthew Herper (Forbes), serían:
- La división de Abbott en dos compañías, una dedicada a los dispositivos médicos (Abbott) y la otra a los productos farmacéuticos (AbbVie).
- La actual pugna entre los antiagregante plaquetarios por el mercado del ictus: Pradaxa (Boehringer Ingelheim), Xarelto (Bayer y Johnson & Johnson) y Eliquis (Bristol-Myers Squibb y Pfizer).
- La competencia entre Gilead, Abbott y Bristol por ver quién es el primero en desarrollar y comercializar una terapia oral (en lugar de inyectable) para el tratamiento de la hepatitis C.
- La llegada de formas orales al mercado de la esclerosis múltiple, como Gilenya, ya comercializado, y BG-12 de Biogen, un producto en el que Wall Street ha depositado grandes esperanzas.
- Datos sobre nuevos medicamentos para tratar la enfermedad de Alzheimer, como solanezumab de Eli Lilly, y bapinezumab de Pfizer, Johnson & Johnson y Elan. Aunque las expectativas para estos productos son bajas, un eventual éxito supondría un notable estímulo en las cotizaciones respectivas.
Hace algunas semanas, Damien Conover (analista de Morningstar), nos daba otras tres razones para ser optimista con la futura evolución de las cotizaciones de las farmacéuticas:
- La mejora de las perspectivas de los pipelines, debido a una mayor concentración de la I+D en áreas con necesidades terapéuticas pobremente cubiertas, como cáncer o inmunología, lo que facilita la aprobación por parte de la FDA.
- La adaptación de las compañías afectadas por el precipicio de las patentes, mediante el ajuste de sus costes.
- El aprovechamiento del alto potencial que ofrecen los mercados emergentes.
¿Están infravaloradas las cotizaciones? ¿Nos encontramos en el momento propicio para invertir?
Thursday, March 22, 2012
Presentación Estudio Aeseg sobre Medicamentos Genéricos
Esta mañana se ha presentado en Madrid el 'Estudio de Conocimiento, Uso y Evaluación de los Medicamentos Genéricos’, elaborado por Metroscopia para la Asociación Española de Medicamentos Genéricos (AESEG).
Para su realización el pasado mes de febrero se entrevistaron telefónicamente a un total de 1.003 indivíduos.
Estas han sido algunas de las principales conclusiones:
- Más del 92 por ciento de los encuestados reconoce haber oído hablar de los medicamentos genéricos
- El 72 por ciento confía en ellos tanto como en los medicamentos de marca
- Más de la mitad (52 por ciento) reconoce tomar algún medicamento genérico de forma habitual (72 por ciento en el caso de los enfermos crónicos)
- Ante una prescripción por principio activo (p. ej. paracetamol) el 53 por ciento de los encuestados se inclinaría, si pudiera escoger, por un genérico
- El 71 por ciento reconoce una eficacia del genérico similar a la del medicamento de marca
- El 75 por ciento opina que es poco o nada frecuente que el farmacéutico cambie el producto prescrito por otro idéntico pero de otra marca o laboratorio
- Al 71 por ciento le da igual que el farmacéutico le cambie un medicamento de marca por un genérico idéntico
- En caso de ser consultados por un familiar o amigo, mientras el 49 por ciento recomendaría un genérico, sólo el 22 por ciento recomendaría la marca
- El 29 por ciento reconoce que alguna vez le han cambiado un tratamiento habitual con un medicamento de marca por un genérico
- De estos, el 92 por ciento afirma no haber sufrido confusión con el cambio
Enlace para abrir el estudio
Tuesday, March 20, 2012
¿El final de las marcas? Cien días de la PPA
El pasado lunes 12 de marzo tuvo lugar en Madrid la segunda
jornada sobre prescripción por principio activo (PPA), organizada por
Contenidos e Información de Salud (el pasado mes de octubre se celebró la primera jornada). La misma permitió analizar la aplicación
práctica del RD 9/2011.
¿Para qué ha servido el RD 9/2011?
En su exposición, José María López (Director General
Editorial en Contenidos) puso de manifiesto las desigualdades en la aplicación
entre las distintas comunidades autónomas, debido a la puesta en marcha de procedimientos
complementarios. En su opinión la prescripción por principio activo no ahorra,
tal y como se pone de manifiesto al comparar las comunidades autónomas donde la
PPA es obligatoria (seis: Andalucía, Baleares, Castilla y León, Canarias,
Madrid y Navarra), con aquellas donde es opcional (las once restantes más Ceuta
y Melilla). En el primer caso el precio medio por receta ha retrocedido un 8,36
por ciento, mientras que en el segundo lo ha hecho un 8,93 por ciento.
Por otra parte, López considera que el RD tampoco ha servido
para homogeneizar el mercado farmacéutico español, otro de los objetivos de la
norma.
Conclusiones a los 100 días de la entrada en vigor
del RD 9/2011
Para Gabriel Morellli, Director
General de IMS, el ahorro de 1.800
millones que se ha producido no ha sido gracias a la PPA, sino como
consecuencia de la aplicación de los precios menores y la rebaja de los
medicamentos de marca para ponerse al mismo precio que los genéricos. Así, la
brecha entre marcas y genéricos se ha reducido, de manera que España resulta
ser el único país del mundo donde se produce este fenómeno.
- Ahorro significativo del SNS en el mercado de retail
- Disminución en la brecha entre la marcas desprotegidas y los genéricos
- Dinámicas muy diferentes no sólo a nivel de CCAA sino también a nivel de zona básica de salud
- Las farmacias cada vez manejan menos referencias y en particular, menos referencias genéricas
- Mayores dificultades en el otorgamiento de licencias a compañías nacionales
- Mayor nivel de descuentos en el canal y mayor nivel de transfers
- Hay compañías innovadoras que han gestionado el cambio y otras que han decidido no participar y ello se nota claramente
El RD se diseñó para generar un
ahorro de 2.400 millones de euros. En 2010 el mercado farmacéutico a PVL tenía
un tamaño de 10.419 millones de
euros. En abril de 2012, tras la rebaja de precios prevista, el mercado se
habrá reducido hasta los 8.580 millones de euros. Un impacto total de -17,6 por
ciento (1.839 millones de euros).
El crecimiento sostenido del
segmento de productos protegidos (+8,8 por ciento en 2011) no es suficiente
para compensar el efecto negativo de las marcas expuestas a la introducción de
genéricos (-22,5 por ciento en 2011).
Tres meses después de la entrada
en vigor de la PPA los farmacéuticos ven como la PPA se incrementa e incluso se
extiende a fármacos cuya patente está en vigor. La evolución tiene signos
contrarios en cada CCAA y está muy ligada al modelo de implantación del RD y a
las medidas locales en vigor. Por
ejemplo, en Andalucía y Galicia cae la cuota de EFG frente a marcas (-10,5
puntos en el primer caso y -5,5 puntos en el segundo).
Dentro de cada CCAA se aprecia
diferencias entre zonas de Atención Primaria. Mientras en Galicia y País Vasco
el comportamiento de los sanibricks (datos de venta de medicamentos por zonas
básicas de salud) es muy homogéneo, no lo es por ejemplo en Andalucía o
Castilla La Mancha.
La cuota de genéricos ha descendido en todas las moléculas
analizadas, excepto en el caso de escitalopram, pues Lundbeck no ha querido
bajar el precio y ha quedado fuera del mercado financiado. El stock en
farmacias de las marcas se ha incrementado ligeramente desde la entrada en
vigor del RD 9/2011. En cambio, el stock de genéricos ha frenado su tendencia
al alza desde noviembre de 2011.
A pesar de que las marcas muestran una tendencia creciente,
no todas presentan el mismo comportamiento. Una gestión activa de la marca
puede permitir conseguir una mejor evolución (en un estudio la marca A gana dos
puntos de cuota, mientras que la B pierde siete puntos).
Wednesday, January 18, 2012
Pfizer y Medivation cancelan el desarrollo de Dimebon
Pfizer y Medivation (una biotecnológica con sede en California) han decidido poner fin a su acuerdo para desarrollar conjuntamente Dimebon (latrepirdina), un producto que había alcanzado la fase 3 de ensayos clínicos y que estaba siendo investigado en enfermedad de Alzheimer (estudio CONCERT).
Dimebon no alcanzó diferencias significativas ni en las pruebas que miden las capacidades cognitivas, ni en las que evalúan el autocuidado y la función diaria.
Hace algunos meses las dos compañías anunciaron los resultados del ensayo de fase 3 HORIZON en pacientes con enfermedad de Huntington. En este caso el ensayo con Dimebon tampoco mostró diferencias estadísticamente significativas en ninguno de los dos tests empleados.
Entre los productos que se encuentran en fase 3 a Pfizer (ver pipeline) aún le queda un producto en investigación para enfermedad de Alzheimer: bapineuzumab, un anticuerpo monoclonal (que llegó a su pipeline a través de la adquisición de Wyeth) cuya diana farmacológica es la proteína beta-amiloide implicada en el desarrollo de la enfermedad. Se espera que al limpiar las placas de esta proteína que se forman en el curso de la enfermedad se pueda retardar su progresión. Estudios anteriores han mostrado una eficacia limitada y algún revés en términos de su seguridad.
Si atendemos a su magnitud sociosanitaria, su evolución y las previsiones epidemiológicas, el tratamiento eficaz de la enfermedad de Alzheimer continúa siendo uno de los retos importantes de nuestra sociedad. Por ahora los únicos productos disponibles en el mercado son los inhibidores de la acetilcolinesterasa y la memantina, que no consiguen detener el progresivo deterioro, tan sólo paliar algo los síntomas y hacer más lenta su evolución.
En busca de alternativas a las estatinas
Se ha observado que algunas personas muestran una mayor actividad de una
proteína denominada PCSK9 (Proproteina Convertasa Subtilisina/kexina Tipo 9),
debido a una mutación en el gen que codifica su síntesis celular. La PCSK9 se
une a los receptores de LDL (lipoproteínas de baja densidad) que se encuentran en la superficie de las células hepáticas e induce su
degradación. Como consecuencia de ello los individuos afectados presentan unos
altos niveles de colesterol en sangre.
El hecho de que la PCSK9 regule el número de receptores de
LDL de los hepatocitos ha llevado a pensar que el
bloqueo de su función podría ofrecer una nueva vía para tratar a individuos con niveles
elevados de colesterol (puedes leer la historia del hallazgo de esta vía en esta información de Reuters). Por ello varias compañías se han lanzado a investigar
sustancias con este propósito.
El pasado mes de noviembre Amgen presentó los datos de un estudio de fase 1 en el que la dosis más alta administrada de su producto AMG145 (anticuerpo monoclonal)
reducía un 64 por ciento los niveles de LDL (el llamado ‘colesterol malo’) en
voluntarios sanos, en comparación con la inyección de un placebo.
Por su parte, Regeneron, una biotecnológica norteamericana, y su socio
Sanofi ya tienen muy avanzado el desarrollo del producto inyectable REGN727
(anticuerpo monoclonal). Otras compañías que ensayan productos anti-PCSK9 son Pfizer,
Merck & Co y Alnylam Pharmaceuticals.
Aunque Isis Pharmaceuticals se encontraba
desarrollando uno de estos productos en colaboración con Bristol-Myers Squibb, recientemente ha decidido cancelar el proyecto y apostar por Kynamro (mipomersen),
el primer representante de una nueva clase terapéutica: los inhibidores de la
síntesis de la apoproteína-B. Isis tiene de socio en este proyecto a Genzyme (subsidaria de
Sanofi).
Recientemente, Stanley Crooke, presidente y consejero delegado de Isis, ha pronosticado el éxito de su producto y un retraso importante en los proyectos de Amgen, Regeneron y Pfizer, debido a posibles objeciones de la FDA sobre su
seguridad, basándose para ello en una carta que la agencia norteamericana ha remitido a todas las
compañías con productos en desarrollo (ver transcripción de una reciente presentación a analistas). Tanto Regeneron como Amgen han manifestado su discrepancia con la opinión de Crooke.
Se espera que una vez comercializados los productos anti-PCSK9 se utilicen en
combinación con estatinas, cuando estas se muestren insuficientes para
controlar los niveles altos de colesterol, o como tratamiento único en un grupo
mucho más reducido de pacientes que no toleran las estatinas.
Labels:
Alnylam,
AMG145,
Amgen,
apoproteína-B,
Bristol-Myers Squibb,
colesterol,
genzyme,
Isis Pharmaceuticals,
Kynamro,
Merck,
mipomersen,
PCSK9,
Pfizer,
Regeneron,
REGN727,
Sanofi,
Stanley Crooke
Subscribe to:
Comments (Atom)